近日,中国农业科学院北京畜牧兽医研究所微生物与酶工程科技创新团队成功改造了植酸酶的热稳定性,实现植酸酶耐受温度高达100 °C。该研究扩展了可用于工业应用的植酸酶库,揭示了酶结构和耐热性之间的复杂关系,为酶修饰相关研究奠定了理论基础。相关研究进展发表在《生物化学杂志(Journal of Biological Chemistry)》期刊。
提高酶的稳定性对于扩大生物技术的应用范围和提高其适应能力至关重要。开发能够耐受高达100 ℃的高温酶的不仅有助于推进酶工程技术,而且拓宽了其在不同领域的潜在应用。为了进一步说明这一概念,研究团队选择了全球市场价值高达5.9亿美元的植酸酶作为验证。通过深入分析晶体结构并实施引入二硫键、进行能量计算和B因子分析等策略,成功地实现了植酸酶的热稳定性理性设计。
Y. intermedia 植酸酶APPA因其理想的酶学性质在饲料工业中显示出巨大的应用潜力,但是它在热稳定性方面不符合制粒过程中瞬时高温处理的技术要求。研究团队最初采用定向进化的方法来提高植酸酶APPA的特性,从随机突变文库中筛选出一个四点突变体APPAmut4,表现出与APPA相当的特性,且表达量有所增加。考虑到异源蛋白的高水平生产在基础研究和工业应用中的重要性和相关性,因此APPAmut4是通过利用基于结构基础的计算方法来提高其热稳定性的理想候选者。团队首先对APPAmut4进行了晶体结构解析,以确定其与野生型相比的差异结构基础。基于APPAmut4(PDB ID:8XM1)的结构基础,采用三种理性设计策略来研究其增强热稳定性的分子设计。首先,团队进行了将二硫键引入APPAmut4的精确工程设计。其次,通过对APPAmut4突变体的展开自由能分析构建虚拟变体库。第三,通过对APPAmut4晶体结构中的B因子确定突变热点。最后,通过这三种策略获得的所有阳性突变变体都被顺序纳入,以鉴定具有优异热稳定性的突变体。
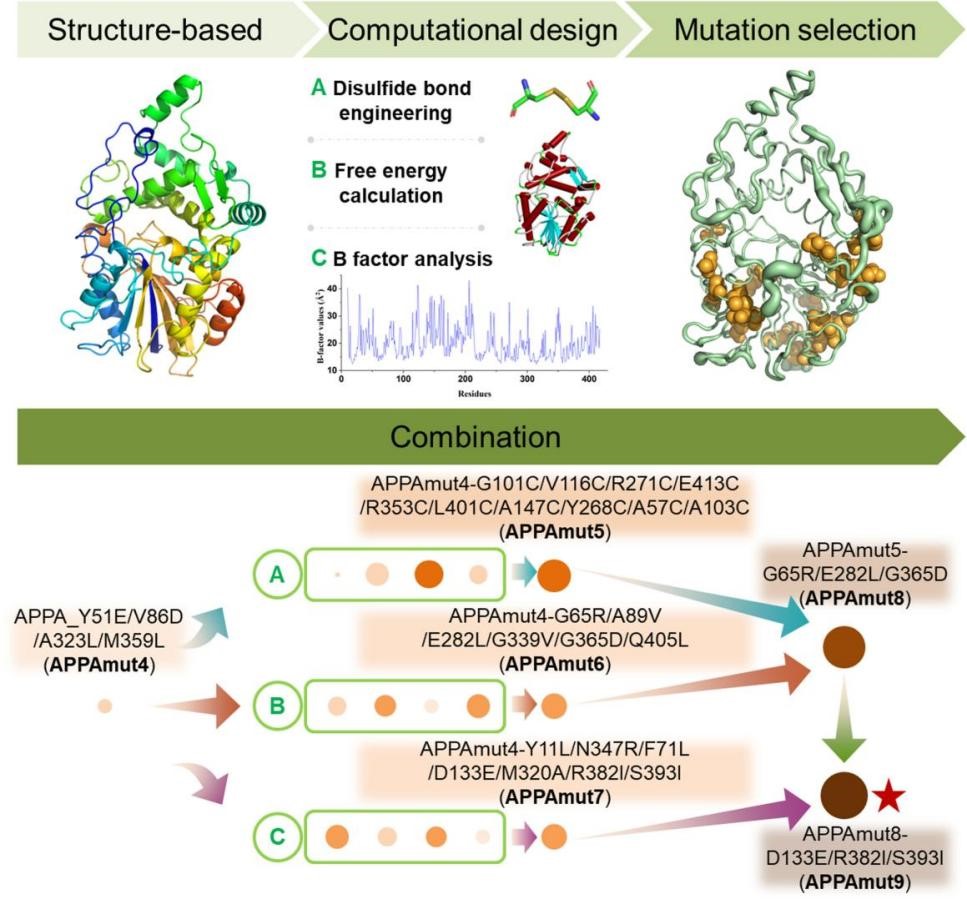
基于APPAmut4结构基础的计算设计示意图
通过迭代组合突变,成功获得了一种突变体APPAmut9,它在保持酶活性的同时具有增强的热稳定性。在95℃下处理5分钟后,它显示出约80%的剩余活性,即使在100 ℃的沸水条件下暴露相同的时间,也能保持约70%的活性。APPAmut9显示出在酶工程研究领域很少观察到的超高热弹性。
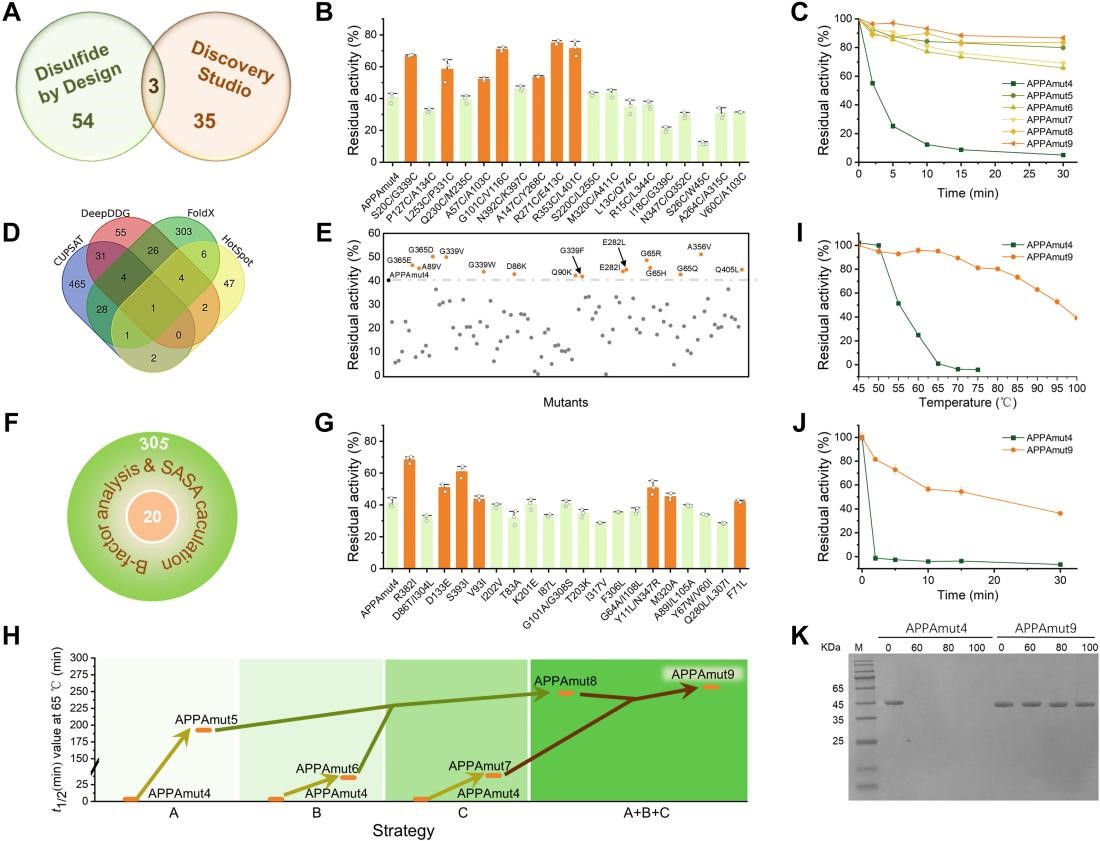
APPAmut4热稳定性增强的示意图
酶的热稳定性在评估工业酶制剂的实用性方面至关重要,因为它能加速反应过程,并通过其高稳定性来降低生产成本。然而,大多数天然酶在高温下容易变性,这凸显了提高酶稳定性以保持其功能的必要性。涂涛研究员通过创新的工程方法,深入探索了酶结构和功能之间的复杂关系,并运用理性设计策略,带领研究团队成功研发出一种能在100 ℃高温下保持催化效率的超级植酸酶。这一成果突破了植酸酶在畜禽饲料中应用的耐热性局限,证明了抗沸煮工程植酸酶的可行性,同时也扩大了适用于工业饲料生产的植酸酶种类。
中国农业科学院北京畜牧兽医研究所的涂涛研究员和黄火清研究员为该文章的共同通讯作者。研究得到了伊利诺伊大学厄巴纳-香槟分校Isaac Cann教授和南京农业大学成艳芬教授的指导和帮助。该研究还得到了国家自然科学基金委、肉鸡体系和中国农业科学院科技创新工程重大科研任务等项目的资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0021925824024943?via%3Dihub










