近日,中国农业科学院北京畜牧兽医研究所微生物与酶工程科技创新团队发布了“酶热稳定性的新见解:“短板”理论和Zero-Shot Hamilton模型”,该项研究进展近日以内封面论文的形式发表于《先进科学(Advanced Science)》期刊,题为“Novel Insights into Enzymatic Thermostability: The “Short Board” Theory and Zero-Shot Hamiltonian Model”。

了解天然稳定酶的热稳定机制,提高酶的热稳定性是酶工程研究的重要内容。尽管各种工程方法得到了发展,但仍有很大的改进空间。本研究提出了一个“短板”理论的新概念,该理论将蛋白质概念化为木桶,每个成分代表一个长短不一的板,木桶的最短板是限制酶的热稳定提升的限制因素。为了验证这一理论,利用具有多个结构域的重要工业酶种α-淀粉酶作为模型酶。利用结构域置换的方法在结构域、残基和原子水平上证实了“短板”的存在及其对热稳定性改善的影响。在此基础上,以α-淀粉酶为对象,建立了一种新的热稳定性设计与预测模型——Zero-Shot hamilton (ZSH)。这种基于热稳定性和深度学习的协同进化方法仅在应用于具有固定短板的酶时表现出显著的成功。“短板”理论与ZSH模型的整合提出了一种提高酶热稳定性的创新工具。
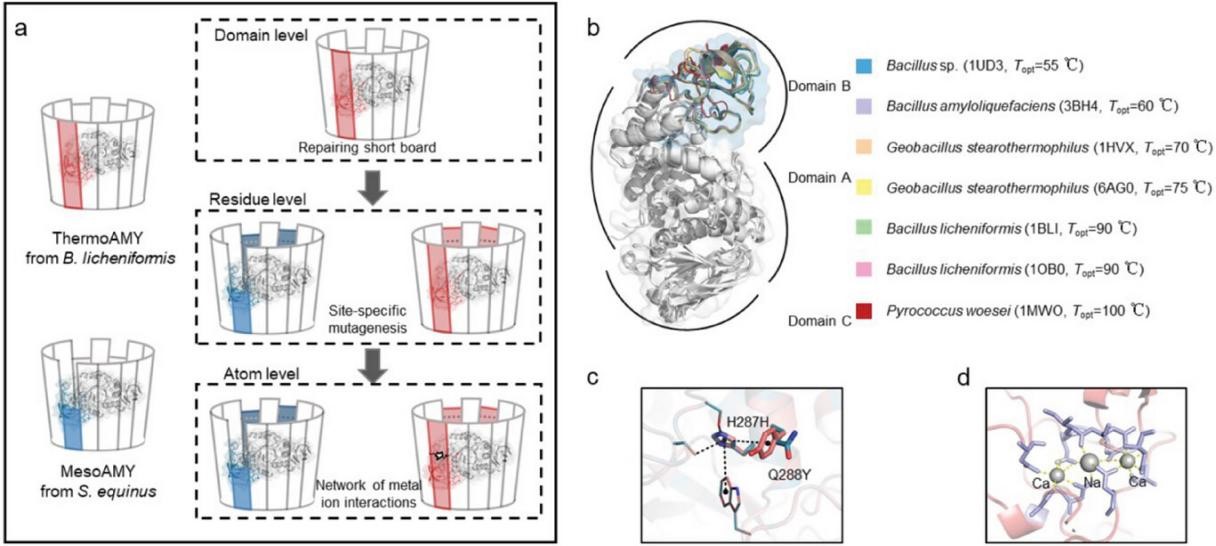
研究首先提出了蛋白质热稳定性“短板理论”,以中温α-淀粉酶(mesoAMY)为模型,通过结构域替换实验,得到了 T m值提升12 °C的替换了B结构域的嵌合酶(meso-AMY-B),证实了B结构域是α-淀粉酶的热稳定性的最“短板”。在解决了蛋白质结构的热稳定性“短板”后,建立了一种有效的工具——ZSH模型来表征蛋白质热稳定性。模型主要关注双点突变带来的热稳定性改变,并通过在Meso-AMY-B上进行定点诱变实验进行验证,实现了约70%的成功率,最优突变体F237R/S240G的 T m值提高了8.5 °C。通过在未修复的模型酶mesoAMY上进行了相同的突变,在mesoAMY-B上显著提升的特异性突变在mesoAMY中并没有产生显著的影响,进一步证实了“短板”修复对蛋白质热稳定性设计的关键作用。通过对热稳定性数据、残基相互作用及ZSH模型中预测的接触图谱的相关性分析,阐明了mesoAMY热稳定性提升的潜在机制,并进一步证实了ZSH设计策略的显著效果。
综上,研究人员通过提出一种增强酶热稳定性的 Zero-Shot 方法,阐明了“短板”在蛋白质工程中的关键作用,从而有可能将其应用扩展到各种生物技术领域。在两个数据集之间观察到的明显差异强调了 “短板” 在调节酶热稳定性方面的关键作用。这种差异可归因于“短板”区域的固有倾向在蛋白质变性过程中展开,导致整个蛋白质分子的结构和功能发生变化。与上位性和远程相互作用不同,“短板”对热稳定性的影响是可预测的,通常会导致有利的突变。然而,完全理解后一种因素如何共同影响热稳定性仍然是一项具有挑战性的任务。
中国农业科学院北京畜牧兽医研究所的涂涛研究员和杭州力文所生物科技有限公司的王浩博博士为该文章的共同通讯作者,中国农业科学院北京畜牧兽医研究所的廖敏博士和昌平实验室的冯世豪博士为该文章的共同第一作者。该研究得到了国家国家自然科学基金、国家重点研发计划等项目的资助。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202402441










