近日,中国农业科学院北京畜牧兽医研究所家畜营养与调控科技创新团队基于糖组学、微生物组学和靶向代谢组学方法,研究了生命早期应激诱导肠道疾病的作用机制,系统揭示了肠道O-型糖链和微生物维持猪肠道稳态的互作机制。相关研究成果发表在国际知名期刊《微生物组(Microbiome)》(IF=16.837/Q1)上。
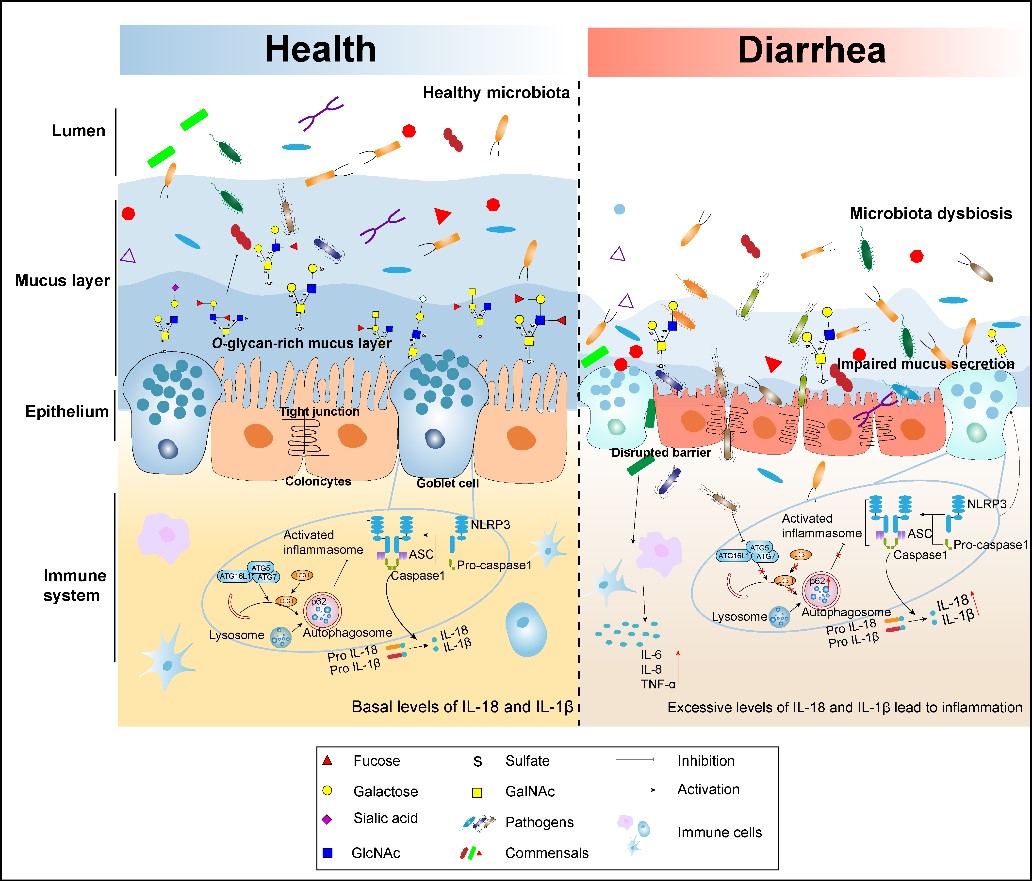
断奶仔猪腹泻是引起仔猪死亡的重要原因,是困扰养猪业的重大难题之一,给生猪产业造成了严重的经济损失。已有研究表明,肠上皮细胞和菌群通过相互调节,可以维持肠道内稳态,控制炎症发生,然而腹泻仔猪肠道黏膜屏障变化特征尚未完全清晰。
研究人员以断奶仔猪为模型,通过UEA凝集素和AB-PAS染色发现腹泻仔猪结肠黏液层形态受损,厚度显著低于健康仔猪,杯状细胞数量也显著减少。使用多孔石墨碳色谱柱的液相色谱-质谱联用技术,建立了猪肠道黏蛋白O-糖基化分析方法,并利用该方法鉴定出猪结肠内含有57种O-型糖结构,发现腹泻仔猪肠道中O-型糖链长度变短,具有抵御病原菌黏附功能的酸性糖丰度显著降低。体外研究进一步发现,黏蛋白O-型糖作为信号分子能够结合大肠杆菌,保护上皮免受炎症损伤,并可作为共生微生物的能量来源,与微生物形成互利共生关系。这一研究结果阐明了肠道O-型糖链和微生物的互作机制,进一步揭示了肠道屏障功能机制,为预防和缓解仔猪腹泻提供新的基础理论依据。同时该研究有助于解析人类婴儿腹泻的疾病机制,为开发新的有效疗法提供了新策略。
该研究得到中国农科院科技创新工程项目支持。夏冰和钟儒清为论文第一作者,张宏福研究员和赵辛教授为通讯作者。
原文链接1:https://doi.org/10.1186/s40168-022-01326-8
原文链接2:https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01326-8










